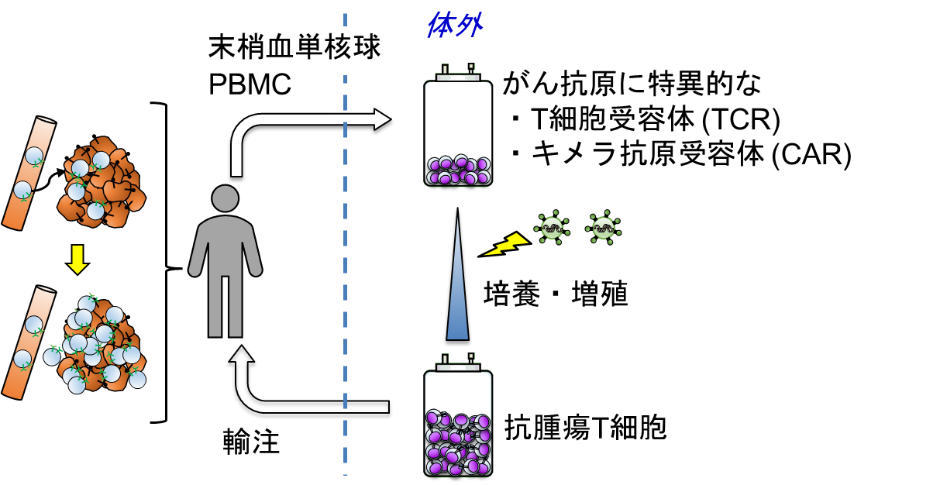
養子免疫療法は、がん細胞で発現する抗原 (がん抗原)を特異的に認識できる抗腫瘍T細胞を体外で準備・増殖させた上で患者に輸注して、がん細胞を特異的に攻撃させる治療法です。当初、腫瘍組織内に浸潤するリンパ球 (tumor infiltrating lymphocyte: TIL)を用いたTIL療法から研究開発が進みましたが、近年では遺伝子工学の発達により、末梢血由来T細胞にがん抗原に特異的なT細胞受容体 (T cell receptor: TCR)やキメラ抗原受容体 (chimeric antigen receptor: CAR)を高効率で導入することで、末梢血中のポリクローナルT細胞をそのまま抗腫瘍T細胞に改変し、治療に用いることができるようになりました。特に、B細胞で発現する抗原CD19を標的としたCAR-T細胞療法がB細胞性腫瘍 (急性リンパ性白血病、悪性リンパ腫)に著効したことから急速に注目を集め、既に実臨床でも再発・難治例に対する標準治療として用いられています (Maude et al. N Engl J Med 2018)。
しかし他の悪性腫瘍、特に固形がんに対するCAR-T細胞療法ではいずれも満足すべき結果が得られておらず、またCD19に対するCAR-T細胞治療においても、完全寛解後の再発率が高いことがわかってきました (Schultz et al. J Clin Oncol 2022)。また有効性とは別に、治療に伴う副作用やコストも適用疾患を拡大していく上で重要な課題です。当研究室ではこれら諸課題を克服するべく、以下に挙げるような研究を行っています。
1)T細胞の長期生存能・エフェクター効果を高めるための改変
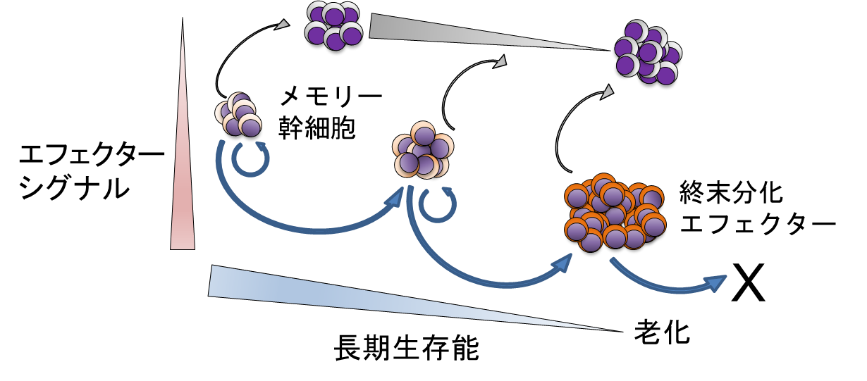
CAR-T細胞などの抗腫瘍T細胞の治療効果を高めるためには、T細胞の長期生存能とエフェクター機能の両面を考慮する必要があります。長期生存にはメモリーT細胞の分化、エフェクター機能にはT細胞の疲弊が重要なキーワードです(下図)。
従来、T細胞による免疫療法では細胞傷害活性、すなわちエフェクター機能が専ら重視されてきましたが、実際には輸注されたT細胞が体内で長期間存続するか、という視点がより重要です(Gattinoni et al. Nat Med 2011)。メモリーT細胞の分化は通常、増殖に伴い不可逆的に進みますが、特定のシグナルを修飾することで自己複製能を高め、分化を抑制することができます。一方、エフェクター機能低下に関わる興味深い概念がT細胞の疲弊 (exhaustion)です。これは持続的・慢性的に抗原刺激を受けたT細胞の増殖能やサイトカイン分泌能などが低下する現象を指し、疲弊T細胞で抑制シグナルを担う代表的な分子であるPD-1に対する阻害抗体の有効性は既に確立されています。しかし疲弊を誘導する機構は本来何のために備わっているか、という視点で考えると、持続的な抗原刺激に曝露されたT細胞が生きながらえるための仕組みという捉え方もできます。実際、PD-1やその制御因子であるTOXを抑制することが必ずしもがんや慢性感染症における治療効果に寄与しないことが報告されています (Odorizzi et al. J Exp Med 2015; Scott et al. Nature 2019)。特に、完全な疲弊に至ったT細胞は、メモリー/エフェクターT細胞とは全く異なるエピジェネティックプロファイルを獲得しており、PD-1阻害抗体では機能が回復しないこともわかってきました (Pauken et al. Science 2016)。
これらのことから、T細胞の分化、疲弊形成のいずれもエピジェネティックプロファイル、これに伴う転写因子群の活性変化を基盤としたT細胞の性質変化が背景にあることが推測されます。私たちはT細胞の状態を個別の遺伝子レベル、シグナル伝達経路レベルで明らかにし、その知見に基づいて改変を加えることにより、持続的な治療効果を高めた抗腫瘍T細胞を開発することを目指しています。近年の遺伝子工学技術の進歩により、レトロウイルスなどによる遺伝子導入に加えて、CRISPR/Cas9により目的遺伝子をノックアウトすることがヒトT細胞においても容易にできるようになりました。T細胞の「質」そのものの改変は、標的抗原を問わずに応用可能なものであり、あらゆるがんに対する養子免疫療法に適用することができると考えています。
2)細胞療法の標準化・汎用化について
CAR-T細胞療法の治療効果は輸注されるT細胞の質に大きく依存します。例えば健常人由来のT細胞と、慢性リンパ性白血病患者さんからのT細胞では、マウスに生着させた同じがん細胞株の治療に用いた場合に効果が大きく異なる (健常人由来T細胞の方が治療効果において優れている)ことが報告されています (Fraietta et al. Nat Med 2018)。現在の養子免疫療法では、ほとんどの場合患者さん自身のT細胞を治療に用いるため、全く同じ工程で製造していても治療効果にばらつきが生じることになります。またそれぞれの患者さんの治療ごとに抗腫瘍T細胞を個別に準備する必要があるため、治療コストが大きくなる要因の1つとなります。これらの課題は「細胞」を治療薬として用いることから必然的に生じるものですので、根本的な解決には人工的な大量生産が可能な薬剤に細胞と同様の機能を持たせることが必要です。CARと類似したコンセプトで、抗CD3抗体と抗CD19抗体を連結して内在性T細胞に抗腫瘍効果を誘導するBiTE (Bispecific T-cell Engager)という抗体医薬が実用化されていますが、CAR-T細胞と比較すると、治療効果が弱いのが現状です。私たちは複雑系である「T細胞」をより深く理解し、その一部の機能を再構築した汎用性のある「人工的な物質」へ転換させるための試みを長期的視野に立った研究として進めています。
さらに、細胞療法をがん以外の疾患にも適用する試みがあります。例えば自己免疫疾患は多くの場合B細胞が重要な役割を果たしますので、上記でも登場したCD19に対するCAR-T細胞は理に適った治療手段になり、ごく最近の臨床試験では難治性の全身性エリテマトーデスに対して有望な治療成績が得られています (Mackensen et al. Nat Med 2022)。このように、様々な局面で「生きた薬」である免疫細胞は活用される可能性を秘めており、私たちの研究室では既存の再発・難治がんに対する治療という枠組みにとらわれない研究を展開しています。
